عنوان الوحدة التفاعلات والحسابات الكيميائية
ستتعرف في هذا الدرس على المصطلحات والمفاهيم العلمية التالية:
Chemical Change
يطرأ على المادة نوعين من التغيرات، هما:
التغير الفيزيائي:
ويؤثر في الخواص الفيزيائية للمادة كحالة المادة (صلبة، سائلة، غازية) وشكلها وحجمها، ولا ينتج عنها تغير في تركيب المادة.
مثال:
عندما يتجمد الماء، يتحول من الحالة السائلة إلى الحالة الصلبة، ويبقى ماءً.
التغير الكيميائي:
ينتج عنه مواد جديدة تختلف في خصائصها عن خصائص المواد الأصلية.
مثال (1):
عند حرق المغنيسيوم بوجود الأكسجين ينتج عنه رماد أبيض يُسمى أكسيد المغنيسيوم، يختلف في خصائصه عن المغنيسيوم والأكسجين.
مثال (2):
يتفاعل عنصري الصوديوم والكلور لإنتاج كلوريد الصوديوم (ملح الطعام),
التفاعل الكيميائي
تُسمى العملية التي تحدث فيها تغيرات كيميائية التفاعل الكيميائي.
التفاعل الكيميائي: عملية يحدث فيها تكسير الروابط بين ذرات المواد المتفاعلة، وتكوين روابط جديدة بين ذرات عناصر المواد الجديدة، وكذلك إعادة ترتيب الذرات دون المساس بنوعها وعددها.
تُسمى المواد التي تدخل في التفاعل الكيميائي: المواد المتفاعلة.
تُسمى المواد التي تنتج من التفاعل الكيميائي: المواد الناتجة.
تختلف الصفات الفيزيائية والكيميائية للمواد الناتجة عن المواد المتفاعلة.
مثال:
يتفاعل جزيء هيدروجين H2 مع جزيء كلور Cl2 لتكوين جزيئين من كلوريد الهيدروجين 2HCl .
وفي هذا التفاعل تتكسر الرابطة التساهمية بين ذرتي الهيدروجين، والرابطة التساهمية بين ذرتي الكلور، وتتكون رابطتان تساهميتان بين كل ذرة هيدروجين مع كل ذرة الكلور.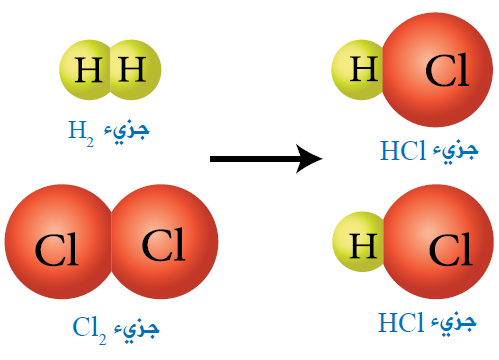
وفي هذا التفاعل تم إعادة ترتيب الذرات دون المساس بنوعها وعددها.
المعادلة الكيميائية الموزونة
Balanced Chemical Equation
يعبر عن التفاعل الكيميائي بمعادلة كيميائية موزونة.
المعادلة الكيميائية الموزونة: تعبير بالرموز والصيغ يبين المواد المتفاعلة والناتجة، ونسب تفاعلها، وحالاتها الفيزيائية، والظروف التي يجري فيها التفاعل بما يحقق قانون حفظ الكتلة.
قانون حفظ الكتلة
قانون حفظ الكتلة: المادة لا تفنى ولا تُستحدث من العدم؛ أي أنّ مجموع كتل المواد المتفاعلة يساوي مجموع كتل المواد الناتجة.
تفسير قانون حفظ الكتلة
يجب أن يكون عدد ذرات كل عنصر ونوعها في المواد المتفاعلة يماثل عدد ذراته ونوعها في المواد الناتجة.
مثال:
يتفاعل غاز الميثان مع غاز الأكسجين لإنتاج غاز ثاني أكسيد الكربون وبخار الماء، وفق المعادلة:
CH4 + O2 → CO2 + H2O
لاحظ أن عدد ذرات الكربون الأكسجين والهيدروجين في طرفي المعادلة غير متساوٍ، ولم يتحقق قانون حفظ الكتلة.

ولتحقيق قانون حفظ الكتلة يضرب في المتفاعلات بالمعامل (2)، كما ويضرب في النواتج بالمعامل (2)، وتصبح المعادلة الكيميائية موزونة.

سؤال: ••••••••
وازن المعادلة الكيميائية الآتية:
Na + O2 → Na2O
الإجابة:
4Na + O2 → 2Na2O
Combustion Reaction
تفاعل الاحتراق: هو تفاعل مادة ما (عنصر أو مركب) مع غاز الأكسجين ويصاحب التفاعل بشكل عام انطلاق طاقة على صورة حرارة أو ضوء.
مثال (1):
عند حرق الفحم (الكربون) بوجود غاز الأكسجين يؤدي إلى انطلاق حرارة، ويعبر عن التفاعل بالمعادلة الآتية:
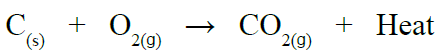
مثال (2):
حرق الهيدروكربونات يؤدي إلى إنتاج غاز ثاني أكسيد الكربون، وبخار الماء، وانطلاق حرارة كما في المعادلة الآتية:
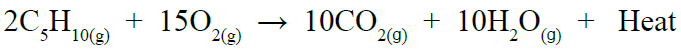
أهمية تفاعلات الاحتراق
أفكر: عند حرق (100g) من الفحم في كمية معلومة من غاز الأكسجين حرقاً تاماً، فإن كمية الناتج تكون أقل من المتوقع.
لأن من نواتج احتراق الفحم تكون غاز ثاني أكسيد الكربون
تفاعل الاتحاد
Combination Reaction
تفاعل الاتحاد: تفاعل يحدث بين مادتين أو أكثر (عناصر أو مركبات) لينتج مركباً واحداً جديداً.
ويمثل تفاعل الاتحاد بالصورة المبسطة الآتية:

مثال (1):
تفاعل تسخين عنصر النحاس مع عنصر الكبريت، إنتاج مركب كبريتيد النحاس (II):

مثال (2):
تفاعل أكسيد المغنيسيوم مع غاز ثاني أكسيد الكربون، لإنتاج كربونات المغنيسيوم:

Single Displacement Reaction
تفاعل الإحلال الأحادي: تفاعل يحل فيه عنصرٌ نشطٌ محلّ عنصر آخر أقل نشاطاً منه في أحد أملاحه.
مثال (1):
عنصر الحديد أكثر نشاطاً من عنصر النحاس؛ لذا عند وضع مسمار من الحديد في محلول كبريتات النحاس، يحل الحديد محل أيونات النحاس، وينتج عن ذلك محلول كبريتات الحديد، وتترسب ذرات النحاس، كما في المعادلة الآتية:
Fe (s) + CuSO4 (aq) → FeSO4 (aq) + Cu (s)
مثال (2):
عنصر النحاس أكثر نشاطاً من عنصر الفضة؛ لذا عند وضع سلك من النحاس في محلول نترات الفضة، يحل النحاس محل أيونات الفضة، وينتج عن ذلك محلول نترات النحاس، وتترسب ذرات الفضة، كما في المعادلة الآتية:
Cu (s) + 2AgNO3 (aq) → Cu(NO3)2 (aq) + 2Ag (s)
أسئلة المحتوى وإجاباتها
أفكر صفحة (11):
أي الشكلين الآتيين يمثل تفاعلاً كيميائياً؟ أفسر إجابتي.
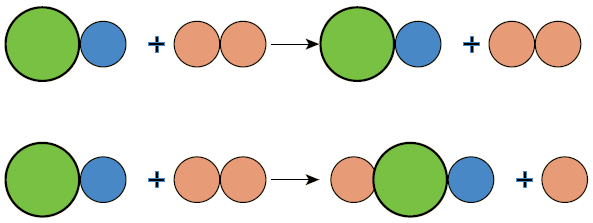
الشكل الثاني؛ لأنه حدث تغير في ترتيب الذرات؛ ما يشير إلى تكسر روابط وتكون أخرى.
الشكل صفحة (11):
أتوقع: ما نوع الرابطة الكيميائية بين ذرات H-H , Cl-Cl , H-Cl ؟
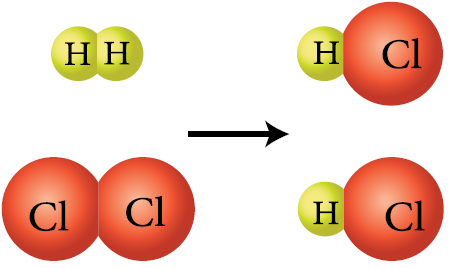
جميعها روابط تساهمية.
الشكل صفحة (12):
أفسر: كيف تغير ترتيب ذرات العناصر بالنسبة إلى بعضها؟
أعداد الذرات المتفاعلة وأنواعها هي نفسها أعداد الذرات الناتجة وأنواعها، ويمكن التعبير عن الشكل بالمعادلة الموزونة الآتية:
2C2H6 + 7O2 → 4CO2 + 6H2O
أفكر صفحة (14):
كيف يتحقق قانون حفظ الكتلة في تفاعل المثال السابق؟
عدد الذرات في المواد المتفاعلة ونوعها نفسه في المواد الناتجة.
أتحقق صفحة (14):
أزن المعادلة الكيميائية الآتية:
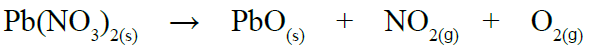
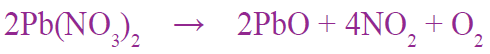
أفكر صفحة (15):
عند حرق (100 g) من الفحم في كمية معلومة من غاز الأكسجين حرقاً تاماً، فإن كمية الناتج تكون أقل من المتوقع.
جزء مفقود على شكل حرارة، أو بخار لم يتم ضبطه.
الشكل صفحة (18):
التحلل الحراري لمركب دايكرومات الأمونيوم.
أكتب المعادلة الكيميائية الموزونة للتفاعل.
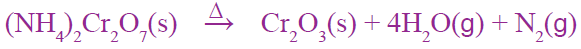
أفكر صفحة (18):
لماذا تترسب ذرات النيكل Ni عند وضع قطعة من عنصر الخارصين Zn في محلول من كبريتات النيكل NiSO4 ؟
وأكتب معادلة التفاعل الحاصل.
لأن عنصر الخارصين أنشط من عنصر النيكل؛ لذلك تحل ذرات عنصر النيكل محل أيونات النيكل؛ فتترسب ذرات النيكل وتنتج كبريتات الخارصين، ويعبر عن ذلك بالمعادلة:
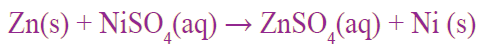
أتحقق صفحة (18):
بماذا يختلف تفاعل الاتحاد عن تفاعل التحلل الحراري؟
تفاعل الاتحاد: تفاعل بين مادتين أو أكثر؛ لإنتاج مادة واحدة جديدة.
تفاعل التحلل: مادة واحدة تتحلل منتجة مادتين أو أكثر.
المردود المئوي
Percentage Yield
يحرص الكيميائيون في المصانع على حساب المردود المئوي للتفاعل، والذي يُمثل بالعلاقة:

الناتج النظري: أكبر كتلة يمكن الحصول عليها من استهلاك كتلة معلومة من إحدى المواد المتفاعلة.
الناتج الفعلي: الكتلة التي نحصل عليها عمليًا في المختبر أو الصناعة.
وفي الغالب يكون الناتج الفعلي أقل من الناتج النظري؛ أي أن المردود المئوي أقل من 100% ، ويعود ذلك لعدّة عوامل، منها:
أتحقق: صفحة (31):
ما الصيغة الجزيئية لمركب كتلته المولية 58 g/mol ، وصيغته الأولية C2H5 علماً بأن الكتل الذرية (H = 1 , C = 12)؟
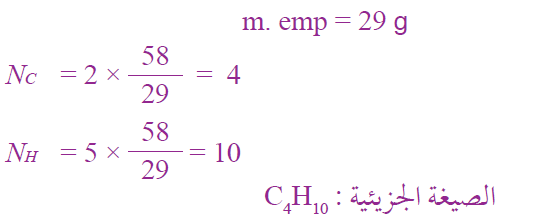
أتحقق: صفحة (35):
اعتماداً على المعادلة الموزونة الآتية:
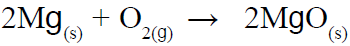
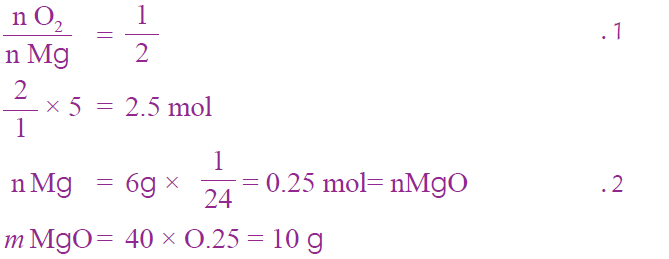
أفكر: صفحة (36):
لماذا تكون نسبة المردود الفعلي أقل بشكل عام من نسبة المردود المتوقع؟
أتحقق: صفحة (36):
ما الفرق بين المردود الفعلي، والمردود المتوقع للتفاعل؟
المردود الفعلي هو كمية المادة الفعلية الناتجة من التفاعل، والتي يحددها الكيميائي من التجارب الدقيقة. أما المردود المتوقع فهو كمية المادة الناتجة المسحوبة نظرياً.
إجابات أسئلة مراجعة الدرس
السؤال الأول:
الفكرة الرئيسة: ما أهمية الحسابات الكيميائية؟
للحسابات الكيميائية أهمية كبيرة في الكيمياء، ومنها:
السؤال الثاني:
أوضح المقصود بكلّ من:
النسبة المئوية بالكتلة: نسبة كتلة العنصر في المركب إلى الكتلة الكلية للمركب.
الصيغة الأولية: أبسط نسبة عددية صحيحة بين ذرات العناصر المكونة للمركب.
الصيغة الجزيئية: صيغة تبين الأعداد الفعلية للذرات وأنواعها في المركب.
المردود المئوي: النسبة المئوية للمردود الفعلي إلى المردود النظري.
السؤال الثالث:
ما الصيغة الأولية لمركبٍ يتكون من تفاعل 2.3g من الصوديوم Na مع 8g من البروم Br ؟
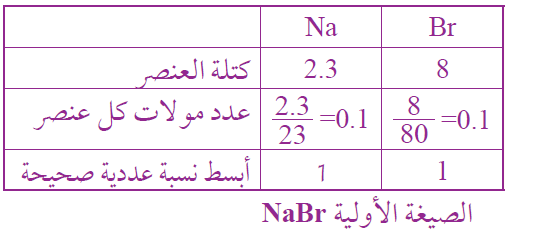
السؤال الرابع:
ما الصيغة الجزيئية لمركبٍ هيدروكربوني يتكون من 92.3% من الكربون، و 7.7% من الهيدروجين؛ علماً بأن الكتلة المولية للمركب 26 g/mol ؟
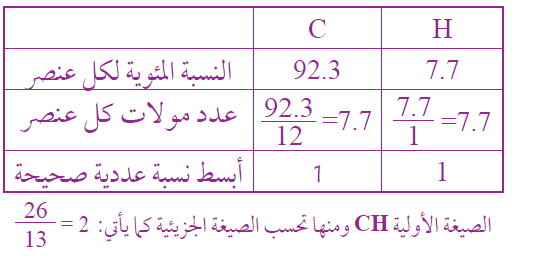
السؤال الخامس:
أحسب كتلة أكسيد الحديد Fe2O3 (III) الناتجة من تفاعل 9.12G من كبريتات الحديد FeSO4 (II) علماً بأن معادلة التفاعل الموزونة هي:
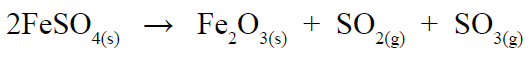
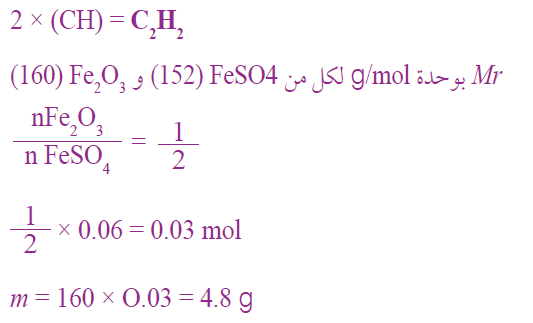
السؤال السادس:
أحسب عدد مولات غاز ثاني أكسيد الكربون CO2 الناتجة من احتراق 6 mol من غاز الإيثان C2H6 احتراقاً تاماً في كمية وافرة من غاز الأكسجين. وذلك المعادلة الموزونة الآتية:
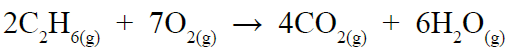
عدد المولات المطلوبة = النسبة المولية x عدد المولات المعطاة
السؤال السابع:
أحسب المردود المئوي لتفاعل ما لإنتاج أكسيد الكالسيوم؛ علماً بأن المردود المتوقع 5.6g والمردود الفعلي 2,8g
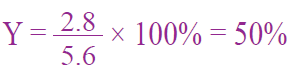
يمكنكم تحميل الشرح PDF هنا
الدرس الأول: التفاعلات الكيميائية
مصطلحات ومفاهيم علمية
ستتعرف في هذا الدرس على المصطلحات والمفاهيم العلمية التالية:
| تفاعل كيميائي | Chemical Reaction |
| تغير كيميائي | Chemical Change |
| قانون حفظ الكتلة | Law of Conservation of Mass |
| تفاعل الاحتراق | Combustion Reaction |
| تفاعل الاتحاد | Combination Reaction |
| تفاعل التحلل (التفكك) الحراري | Thermal Decomposition Reaction |
| تفاعل الإحلال الأحادي | Single Displacement Reaction |
التغير الكيميائي
Chemical Change
يطرأ على المادة نوعين من التغيرات، هما:
التغير الفيزيائي:
ويؤثر في الخواص الفيزيائية للمادة كحالة المادة (صلبة، سائلة، غازية) وشكلها وحجمها، ولا ينتج عنها تغير في تركيب المادة.
مثال:
عندما يتجمد الماء، يتحول من الحالة السائلة إلى الحالة الصلبة، ويبقى ماءً.
التغير الكيميائي:
ينتج عنه مواد جديدة تختلف في خصائصها عن خصائص المواد الأصلية.
مثال (1):
عند حرق المغنيسيوم بوجود الأكسجين ينتج عنه رماد أبيض يُسمى أكسيد المغنيسيوم، يختلف في خصائصه عن المغنيسيوم والأكسجين.
| أكسيد المغنيسيوم | الأكسجين | المغنيسيوم |
| رماد أبيض اللون | غاز عديم اللون | فلز صلب فضي اللون |
يتفاعل عنصري الصوديوم والكلور لإنتاج كلوريد الصوديوم (ملح الطعام),
| كلوريد الصوديوم | الكلور | الصوديوم |
| ملح أبيض اللون، يحتاج الجسم إليه | غاز لونه أصفر مخضر، وسام | فلز صلب فضي اللون يتفاعل بشدة مع الماء |
تُسمى العملية التي تحدث فيها تغيرات كيميائية التفاعل الكيميائي.
التفاعل الكيميائي: عملية يحدث فيها تكسير الروابط بين ذرات المواد المتفاعلة، وتكوين روابط جديدة بين ذرات عناصر المواد الجديدة، وكذلك إعادة ترتيب الذرات دون المساس بنوعها وعددها.
تُسمى المواد التي تدخل في التفاعل الكيميائي: المواد المتفاعلة.
تُسمى المواد التي تنتج من التفاعل الكيميائي: المواد الناتجة.
تختلف الصفات الفيزيائية والكيميائية للمواد الناتجة عن المواد المتفاعلة.
مثال:
يتفاعل جزيء هيدروجين H2 مع جزيء كلور Cl2 لتكوين جزيئين من كلوريد الهيدروجين 2HCl .
وفي هذا التفاعل تتكسر الرابطة التساهمية بين ذرتي الهيدروجين، والرابطة التساهمية بين ذرتي الكلور، وتتكون رابطتان تساهميتان بين كل ذرة هيدروجين مع كل ذرة الكلور.

وفي هذا التفاعل تم إعادة ترتيب الذرات دون المساس بنوعها وعددها.
المعادلة الكيميائية الموزونة
Balanced Chemical Equation
يعبر عن التفاعل الكيميائي بمعادلة كيميائية موزونة.
المعادلة الكيميائية الموزونة: تعبير بالرموز والصيغ يبين المواد المتفاعلة والناتجة، ونسب تفاعلها، وحالاتها الفيزيائية، والظروف التي يجري فيها التفاعل بما يحقق قانون حفظ الكتلة.
قانون حفظ الكتلة
قانون حفظ الكتلة: المادة لا تفنى ولا تُستحدث من العدم؛ أي أنّ مجموع كتل المواد المتفاعلة يساوي مجموع كتل المواد الناتجة.
تفسير قانون حفظ الكتلة
يجب أن يكون عدد ذرات كل عنصر ونوعها في المواد المتفاعلة يماثل عدد ذراته ونوعها في المواد الناتجة.
مثال:
يتفاعل غاز الميثان مع غاز الأكسجين لإنتاج غاز ثاني أكسيد الكربون وبخار الماء، وفق المعادلة:
CH4 + O2 → CO2 + H2O
لاحظ أن عدد ذرات الكربون الأكسجين والهيدروجين في طرفي المعادلة غير متساوٍ، ولم يتحقق قانون حفظ الكتلة.
ولتحقيق قانون حفظ الكتلة يضرب في المتفاعلات بالمعامل (2)، كما ويضرب في النواتج بالمعامل (2)، وتصبح المعادلة الكيميائية موزونة.
سؤال: ••••••••
وازن المعادلة الكيميائية الآتية:
Na + O2 → Na2O
الإجابة:
4Na + O2 → 2Na2O
تفاعل الاحتراق
Combustion Reaction
تفاعل الاحتراق: هو تفاعل مادة ما (عنصر أو مركب) مع غاز الأكسجين ويصاحب التفاعل بشكل عام انطلاق طاقة على صورة حرارة أو ضوء.
مثال (1):
عند حرق الفحم (الكربون) بوجود غاز الأكسجين يؤدي إلى انطلاق حرارة، ويعبر عن التفاعل بالمعادلة الآتية:
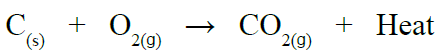
مثال (2):
حرق الهيدروكربونات يؤدي إلى إنتاج غاز ثاني أكسيد الكربون، وبخار الماء، وانطلاق حرارة كما في المعادلة الآتية:
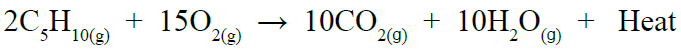
أهمية تفاعلات الاحتراق
- تفيد الحرارة الناتجة عن حرق الفحم أو الخشب أو الوقود في التدفئة وتحريك وسائل المواصلات والطهي.
- احتراق الغذاء في الجسم يزوده بالطاقة اللازمة لأداء وظائفه الحيوية المتنوعة.
أفكر: عند حرق (100g) من الفحم في كمية معلومة من غاز الأكسجين حرقاً تاماً، فإن كمية الناتج تكون أقل من المتوقع.
لأن من نواتج احتراق الفحم تكون غاز ثاني أكسيد الكربون
تفاعل الاتحاد
Combination Reaction
تفاعل الاتحاد: تفاعل يحدث بين مادتين أو أكثر (عناصر أو مركبات) لينتج مركباً واحداً جديداً.
ويمثل تفاعل الاتحاد بالصورة المبسطة الآتية:
مثال (1):
تفاعل تسخين عنصر النحاس مع عنصر الكبريت، إنتاج مركب كبريتيد النحاس (II):
مثال (2):
تفاعل أكسيد المغنيسيوم مع غاز ثاني أكسيد الكربون، لإنتاج كربونات المغنيسيوم:
تفاعل الإحلال الأحادي
Single Displacement Reaction
تفاعل الإحلال الأحادي: تفاعل يحل فيه عنصرٌ نشطٌ محلّ عنصر آخر أقل نشاطاً منه في أحد أملاحه.
مثال (1):
عنصر الحديد أكثر نشاطاً من عنصر النحاس؛ لذا عند وضع مسمار من الحديد في محلول كبريتات النحاس، يحل الحديد محل أيونات النحاس، وينتج عن ذلك محلول كبريتات الحديد، وتترسب ذرات النحاس، كما في المعادلة الآتية:
Fe (s) + CuSO4 (aq) → FeSO4 (aq) + Cu (s)
مثال (2):
عنصر النحاس أكثر نشاطاً من عنصر الفضة؛ لذا عند وضع سلك من النحاس في محلول نترات الفضة، يحل النحاس محل أيونات الفضة، وينتج عن ذلك محلول نترات النحاس، وتترسب ذرات الفضة، كما في المعادلة الآتية:
Cu (s) + 2AgNO3 (aq) → Cu(NO3)2 (aq) + 2Ag (s)
أسئلة المحتوى وإجاباتها
أفكر صفحة (11):
أي الشكلين الآتيين يمثل تفاعلاً كيميائياً؟ أفسر إجابتي.

الشكل الثاني؛ لأنه حدث تغير في ترتيب الذرات؛ ما يشير إلى تكسر روابط وتكون أخرى.
الشكل صفحة (11):
أتوقع: ما نوع الرابطة الكيميائية بين ذرات H-H , Cl-Cl , H-Cl ؟

جميعها روابط تساهمية.
الشكل صفحة (12):
أفسر: كيف تغير ترتيب ذرات العناصر بالنسبة إلى بعضها؟
أعداد الذرات المتفاعلة وأنواعها هي نفسها أعداد الذرات الناتجة وأنواعها، ويمكن التعبير عن الشكل بالمعادلة الموزونة الآتية:
2C2H6 + 7O2 → 4CO2 + 6H2O
أفكر صفحة (14):
كيف يتحقق قانون حفظ الكتلة في تفاعل المثال السابق؟
عدد الذرات في المواد المتفاعلة ونوعها نفسه في المواد الناتجة.
أتحقق صفحة (14):
أزن المعادلة الكيميائية الآتية:
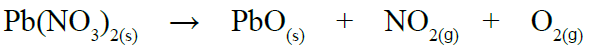
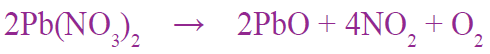
أفكر صفحة (15):
عند حرق (100 g) من الفحم في كمية معلومة من غاز الأكسجين حرقاً تاماً، فإن كمية الناتج تكون أقل من المتوقع.
جزء مفقود على شكل حرارة، أو بخار لم يتم ضبطه.
الشكل صفحة (18):
التحلل الحراري لمركب دايكرومات الأمونيوم.
أكتب المعادلة الكيميائية الموزونة للتفاعل.
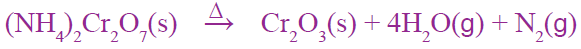
أفكر صفحة (18):
لماذا تترسب ذرات النيكل Ni عند وضع قطعة من عنصر الخارصين Zn في محلول من كبريتات النيكل NiSO4 ؟
وأكتب معادلة التفاعل الحاصل.
لأن عنصر الخارصين أنشط من عنصر النيكل؛ لذلك تحل ذرات عنصر النيكل محل أيونات النيكل؛ فتترسب ذرات النيكل وتنتج كبريتات الخارصين، ويعبر عن ذلك بالمعادلة:
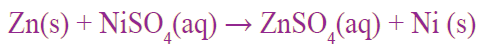
أتحقق صفحة (18):
بماذا يختلف تفاعل الاتحاد عن تفاعل التحلل الحراري؟
تفاعل الاتحاد: تفاعل بين مادتين أو أكثر؛ لإنتاج مادة واحدة جديدة.
تفاعل التحلل: مادة واحدة تتحلل منتجة مادتين أو أكثر.
إجابات أسئلة مراجعة الدرس
السؤال الأول:
الفكرة الرئيسة: أوضح المقصود بكلّ من:
تفاعل الاتحاد: تفاعل يحدث بين مادتين أو أكثر (عناصر أو مركبات) لينتج مركباً واحداً جديداً.
التفاعل الكيميائي: عملية يحدث فيها تكسير الروابط بين ذرات المواد المتفاعلة، وتكوين روابط جديدة بين ذرات عناصر المواد الجديدة، وكذلك إعادة ترتيب الذرات دون المساس بنوعها وعددها.
تفاعل التحلل الحراري: تحلل مركب واحدٍ بالحرارة منتجاً مادتين أو أكثر (عناصر أو مركبات).
تفاعل الاحتراق: هو تفاعل مادة ما (عنصر أو مركب) مع غاز الأكسجين ويصاحب التفاعل بشكل عام انطلاق طاقة على صورة حرارة أو ضوء.
تفاعل الإحلال الأحادي: تفاعل يحل فيه عنصرٌ نشطٌ محل عنصر آخر أقل نشاطاً منه في أحد أملاحه.
السؤال الثاني:
أفسر قانون حفظ الكتلة.
عدد الذرات في المواد المتفاعلة ونوعها يماثل عددها ونوعها في المواد الناتجة، وهذا يقود إلى أن كتلة المواد المتفاعلة تساوي كتلة المواد الناتجة.
السؤال الثالث:
أزن المعادلات الكيميائية الآتية:
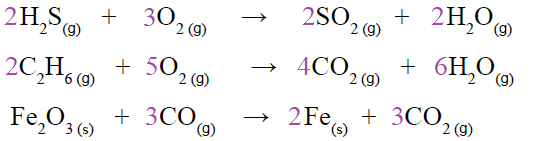
السؤال الرابع:
أصنف التفاعلات الآتية إلى أنواعها:
التفاعل الأول: اتحاد.
التفاعل الثاني: تحلل.
التفاعل الثالث: اتحاد، ويمكن اعتباره تفاعل احتراق.
التفاعل الرابع: الإحلال الأحادي.
السؤال الخامس:
أميز التفاعل الآتي الموضح في الشكل، وأفسره.
التفاعل من نوع الإحلال الأحادي؛ حيث حل العنصر النشط (C) محل العنصر (B) الأقل نشاطاً.
السؤال السادس:
أفسر قانون حفظ الكتلة من خلال التفاعل الآتي:
عدد ذرات الهيدروجين في المتفاعلات يساوي عدد ذرات الهيدروجين في النواتج، وعدد ذرات الأكسجين في المتفاعلات يساوي عدد ذرات الأكسجين في النواتج.

الدرس الثاني: المول والكتلة المولية
مصطلحات ومفاهيم علمية
ستتعرف في هذا الدرس على المصطلحات والمفاهيم العلمية التالية:
السؤال الأول:
الفكرة الرئيسة: أوضح المقصود بكلّ من:
تفاعل الاتحاد: تفاعل يحدث بين مادتين أو أكثر (عناصر أو مركبات) لينتج مركباً واحداً جديداً.
التفاعل الكيميائي: عملية يحدث فيها تكسير الروابط بين ذرات المواد المتفاعلة، وتكوين روابط جديدة بين ذرات عناصر المواد الجديدة، وكذلك إعادة ترتيب الذرات دون المساس بنوعها وعددها.
تفاعل التحلل الحراري: تحلل مركب واحدٍ بالحرارة منتجاً مادتين أو أكثر (عناصر أو مركبات).
تفاعل الاحتراق: هو تفاعل مادة ما (عنصر أو مركب) مع غاز الأكسجين ويصاحب التفاعل بشكل عام انطلاق طاقة على صورة حرارة أو ضوء.
تفاعل الإحلال الأحادي: تفاعل يحل فيه عنصرٌ نشطٌ محل عنصر آخر أقل نشاطاً منه في أحد أملاحه.
السؤال الثاني:
أفسر قانون حفظ الكتلة.
عدد الذرات في المواد المتفاعلة ونوعها يماثل عددها ونوعها في المواد الناتجة، وهذا يقود إلى أن كتلة المواد المتفاعلة تساوي كتلة المواد الناتجة.
السؤال الثالث:
أزن المعادلات الكيميائية الآتية:
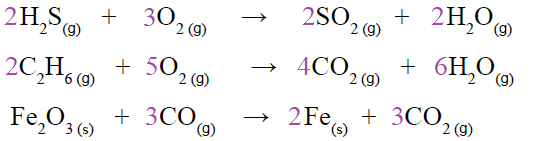
السؤال الرابع:
أصنف التفاعلات الآتية إلى أنواعها:
التفاعل الأول: اتحاد.
التفاعل الثاني: تحلل.
التفاعل الثالث: اتحاد، ويمكن اعتباره تفاعل احتراق.
التفاعل الرابع: الإحلال الأحادي.
السؤال الخامس:
أميز التفاعل الآتي الموضح في الشكل، وأفسره.
التفاعل من نوع الإحلال الأحادي؛ حيث حل العنصر النشط (C) محل العنصر (B) الأقل نشاطاً.
السؤال السادس:
أفسر قانون حفظ الكتلة من خلال التفاعل الآتي:
عدد ذرات الهيدروجين في المتفاعلات يساوي عدد ذرات الهيدروجين في النواتج، وعدد ذرات الأكسجين في المتفاعلات يساوي عدد ذرات الأكسجين في النواتج.

الدرس الثاني: المول والكتلة المولية
مصطلحات ومفاهيم علمية
ستتعرف في هذا الدرس على المصطلحات والمفاهيم العلمية التالية:
| المول | Mole |
| عدد أفوجادرو | Avogadro’s Number |
| الكتلة المولية | Molar Mass |
| الكتلة الذرية النسبية | Relative Atomic Mass |
| الكتلة الجزيئية | Molecular Mass |
| كتلة الصيغة | Formula Mass |
مفهوم المول
The Mole Concept
نستخدم في تعبيراتنا الكثير من الكلمات التي تعبر عن الأعداد، فمثلاً نقول زوجٌ من الأحذية، قرنٌ من الزمان، وعقدٌ من السنوات، ودزينة من الدفاتر وغيرها.
يستخدم في الكيمياء تعبير المول ويعني 6.022 × 2310 ذرة أو أيون أو جزيء أو إلكترون وغيرها.
يسمى العدد 6,022 × 2310 بعدد أفوجادرو نسبة إلى العالم الإيطالي أماديو أفوجادرو.
فلو كان لديك مولاً واحداً من ذرات الحديد فهذا يعني أن لديك 6.022 × 2310 ذرة حديد.
ولو كان لديك مولاً واحداً من جزيئات الأكسجين فهذا يعني أن لديك 6.022 × 2310 جزيء أكسجين وهكذا.
الكتلة المولية
هب أن هناك متجراً يبيع مواد كيمياوية وطُلب منك أن تشتري مولاً من ذرات الصوديوم، فما عدد ذرات الصوديوم التي على التاجر أن يعدها لك لتحصل على طلبك؟
بالتأكيد سيعد لك 6,022 × 2310 ذرة صوديوم، والأمر غاية في الصعوبة، لذا تم استخدام مفهوم الكتلة المولية.
تسمى كتلة المول الواحد من المادة الكتلة المولية.
في حالة الذرات تساوي الكتلة المولية الكتلة الذرية للعنصر.
في حالة الجزيئات تساوي الكتلة المولية الكتلة الجزيئية للجزيء.
مثال (1):
إذا كان لديك مول من ذرات الصوديوم، فما كتلته المولية، وما عدد ذرات الصوديوم في المول الواحد منه.
الكتلة الذرية للصوديوم = 23 وحدة كتل ذرية.
وهذا يعني أن:
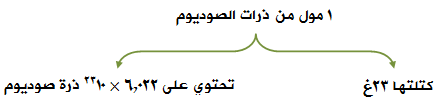
مثال (2):
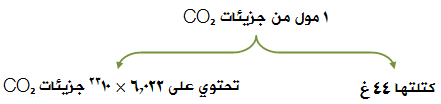
إذا كان لديك مول من جزيئات غاز ثاني أكسيد الكربون CO2 ، فما كتلتها المولية، وما عدد جزيئات ثاني أكسيد الكربون في المول الواحد منها؟
الكتلة الذرية للكربون = 12
الكتلة الذرية للأكسجين = 16
الحل:
لحساب الكتلة المولية لمول واحد من غاز CO2 نحسب الكتلة الجزيئية له:
الكتلة الجزيئية = (عدد ذرات الكربون × كتلته الذرية) + (عدد ذرات الأكسجين × كتلته الذرية)
الكتلة الجزيئية = (1 × 12) + (2 × 16)
الكتلة الجزيئية = (12) + (32) = 44 وحدة كتل جزيئية.
الكتلة الجزيئية = الكتلة المولية = 44غ/مول.
ماذا يعني أن تكون الكتلة المولية لثاني أكسيد الكربون تساوي 44 ؟
سؤال:
بالرجوع إلى قيم الكتل الذرية في الجدول الدوري احسب الكتل المولية للماء H2O .
الحل:
الكتلة المولية للماء = (عدد ذرات الهيدروجين × كتلته الذرية) + (عدد ذرات الأكسجين × كتلته الذرية)
الكتلة المولية للماء = (2 × 1) + (1 × 16) = 18 غ/مول.
الكتلة الجزيئية
Molecular Mass

يمكن اعتبار الكتلة الذرية التقريبية للأكسجين = 16 تسهيلاً للحسابات.
تعلم بأن الأكسجين يوجد في الطبيعة على شكل جزي O2 ، فما كتلته الجزيئية؟
تحسب الكتلة الجزيئية لجزيء الأكسجين بضرب عدد ذرات الأكسجين في الكتلة الذرية التقريبية له.
الكتلة الجزيئية التقريبية لجزيء الأكسجين = 2 × 16
= 32 وحدة كتل ذرية.
ولحساب الكتلة الجزيئية التقريبية للجزيئات التي تحتوي على ذرات عناصر مختلفة نجمع حاصل ضرب كلّ ذرة بكتلتها الذرية التقريبية.
مثال:
حساب الكتلة الجزيئية التقريبية للماء H2O .
الكتلة الذرية التقريبية للهيدروجين = 1
الكتلة الذرية التقريبية للأكسجين = 16
الحل:
لاحظ أن جزيء الماء يحتوي على ذرتي هيدروجين، وذرة أكسجين واحدة، وعليه فإن الكتلة الجزيئية التقريبية للماء تحسب كالتالي:
الكتلة الجزيئية للماء = (1 × 16 ) + (2 × 1)
= 18 وحدة كتل ذرية.
سؤال: ••••••••
بالرجوع إلى الجدول الدوري احسب الكتلة الجزيئية لكلٍّ من المواد الآتية:
H2SO4 , MgF2 , NaCl , Cl2
الإجابة:
الكتلة الجزيئية لـ Cl2 = (2 × 35,5)
= 71 وحدة كتل ذرية.
الكتلة الجزيئية لـ NaCl = (1 × 23 ) + (1 × 35,5)
= 58,5 وحدة كتل ذرية.
الكتلة الجزيئية لـ MgF2 = (1 × 24 ) + (2 × 19)
= 62 وحدة كتل ذرية.
الكتلة الجزيئية لـ H2SO4 = (2 × 1 ) + (1 × 32) + (4 × 16)
= 98 وحدة كتل ذرية.
أسئلة المحتوى وإجاباتها
أتحقق صفحة (23):
1- أحسب الكتلة الجزيئية لجزيء الجلوكوز C6H12O6
الكتل الذرية (O = 16 , C = 12 , H = 1).
= (Am H x N) Mm = (Am C x N) + (Am O x N)
Mm = (12 x 1) + (12 x 6) + (16 x 6) = 180 amu
2- أحسب كتلة الصيغة للمركب NaCl
الكتل الذرية (Cl = 35.5 , Na = 23).
Fm = (Am Na x N) + (Am Cl x N)
Fm = (23 x 1) + (35.5 x 1) = 58.5 amu
أفكر صفحة (25):
ما نوع الجسيمات في كل مما يأتي:
Na , N2 , K+ , NaCl ؟
Na : ذرات.
N2 : جزيئات.
K+ : أيونات.
NaCl : وحدات صيغة.
أتحقق صفحة (26):
1- أحسب عدد ذرات عنصر البوتاسيوم K الموجودة في 1 x 103 منه؟
N = NA x n
N = 6.022 x 1026
2- عينة من مركب ما كتلتها 4 g ، والكتلة المولية Mr للمركب؛ فما عدد المولات n ؟
n = 0.1 mol
إجابات أسئلة مراجعة الدرس
السؤال الأول:
الفكرة الرئيسة: أوضح المقصود بكلّ من:
الكتلة الذرية النسبية: متوسط الكتل الذرية لنظائر ذرة عنصر ما.
الكتلة الجزيئية النسبية: مجموع الكتل الذرية النسبية للذرات الموجودة في الجزيء الذي ترتبط ذراته بروابط تساهمية مقيسة بوحدة amu .
الكتلة المولية: كتلة المول الواحد من دقائق المادة.
كتلة الصيغة النسبية: مجموع الكتل الذرية للعناصر في وحدة الصيغة للمركب الأيوني.
المول: الوحدة الدولية التي تُستخدم في قياس كميات المواد في التفاعلات الكيميائية.
السؤال الثاني:
أجد الكتلة المولية (Mr) لكلّ من C2H5OH , CH4 .
C2H5OH = (12 x 2) + (16 x 1) + (1 x 6) = 46 g/mol
CH4 = (12 x 1) + (1 x 4) = 16 g/mol
السؤال الثالث:
أجد كتلة الصيغة (Fm) للمركبين Ca(OH)2 , Mg(NO3)2 .
Mg(NO3)2 = 128 g/mol
Ca(OH)2 = 128 g/mol
السؤال الرابع:
أحسب عدد المولات (n) الموجودة في 72g من عنصر المغنيسيوم.
n = 3 mol
السؤال الخامس:
أحسب كتلة 0.1 mol من ذرات الألمنيوم.
0.1 مول كتلته 2.7 g
السؤال السادس:
أحسب عدد جزيئات NH3 الموجودة في 2 مول منها.
N = 6.022 x 1023 x 2 = 1.2 x 1024
السؤال السابع:
أوضح المقصود بعدد أفوجادرو.
عدد أفوجادرو هو 6.022 x 1023 من الذرات أو الأيونات أو الجزيئات أو وحدات الصيغة.
السؤال الثامن:
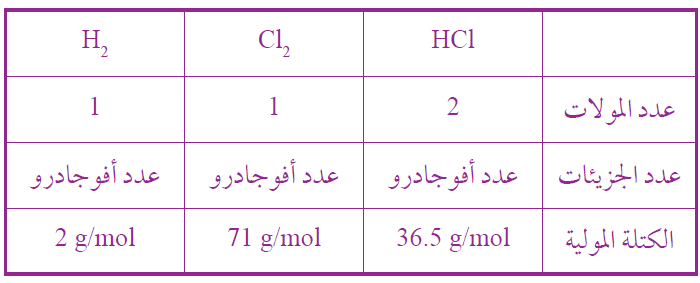
أكمل الجدول الآتي:
الدرس الثالث: الحسابات الكيميائية
مصطلحات ومفاهيم علمية
ستتعرف في هذا الدرس على المصطلحات والمفاهيم العلمية التالية:
The Mole Concept
نستخدم في تعبيراتنا الكثير من الكلمات التي تعبر عن الأعداد، فمثلاً نقول زوجٌ من الأحذية، قرنٌ من الزمان، وعقدٌ من السنوات، ودزينة من الدفاتر وغيرها.
يستخدم في الكيمياء تعبير المول ويعني 6.022 × 2310 ذرة أو أيون أو جزيء أو إلكترون وغيرها.
يسمى العدد 6,022 × 2310 بعدد أفوجادرو نسبة إلى العالم الإيطالي أماديو أفوجادرو.
فلو كان لديك مولاً واحداً من ذرات الحديد فهذا يعني أن لديك 6.022 × 2310 ذرة حديد.
ولو كان لديك مولاً واحداً من جزيئات الأكسجين فهذا يعني أن لديك 6.022 × 2310 جزيء أكسجين وهكذا.
الكتلة المولية
هب أن هناك متجراً يبيع مواد كيمياوية وطُلب منك أن تشتري مولاً من ذرات الصوديوم، فما عدد ذرات الصوديوم التي على التاجر أن يعدها لك لتحصل على طلبك؟
بالتأكيد سيعد لك 6,022 × 2310 ذرة صوديوم، والأمر غاية في الصعوبة، لذا تم استخدام مفهوم الكتلة المولية.
تسمى كتلة المول الواحد من المادة الكتلة المولية.
في حالة الذرات تساوي الكتلة المولية الكتلة الذرية للعنصر.
في حالة الجزيئات تساوي الكتلة المولية الكتلة الجزيئية للجزيء.
مثال (1):
إذا كان لديك مول من ذرات الصوديوم، فما كتلته المولية، وما عدد ذرات الصوديوم في المول الواحد منه.
الكتلة الذرية للصوديوم = 23 وحدة كتل ذرية.
وهذا يعني أن:

مثال (2):
إذا كان لديك مول من جزيئات غاز ثاني أكسيد الكربون CO2 ، فما كتلتها المولية، وما عدد جزيئات ثاني أكسيد الكربون في المول الواحد منها؟
الكتلة الذرية للكربون = 12
الكتلة الذرية للأكسجين = 16
الحل:
لحساب الكتلة المولية لمول واحد من غاز CO2 نحسب الكتلة الجزيئية له:
الكتلة الجزيئية = (عدد ذرات الكربون × كتلته الذرية) + (عدد ذرات الأكسجين × كتلته الذرية)
الكتلة الجزيئية = (1 × 12) + (2 × 16)
الكتلة الجزيئية = (12) + (32) = 44 وحدة كتل جزيئية.
الكتلة الجزيئية = الكتلة المولية = 44غ/مول.
ماذا يعني أن تكون الكتلة المولية لثاني أكسيد الكربون تساوي 44 ؟

سؤال:
بالرجوع إلى قيم الكتل الذرية في الجدول الدوري احسب الكتل المولية للماء H2O .
الحل:
الكتلة المولية للماء = (عدد ذرات الهيدروجين × كتلته الذرية) + (عدد ذرات الأكسجين × كتلته الذرية)
الكتلة المولية للماء = (2 × 1) + (1 × 16) = 18 غ/مول.
الكتلة الجزيئية
Molecular Mass

يمكن اعتبار الكتلة الذرية التقريبية للأكسجين = 16 تسهيلاً للحسابات.
تعلم بأن الأكسجين يوجد في الطبيعة على شكل جزي O2 ، فما كتلته الجزيئية؟
تحسب الكتلة الجزيئية لجزيء الأكسجين بضرب عدد ذرات الأكسجين في الكتلة الذرية التقريبية له.
الكتلة الجزيئية التقريبية لجزيء الأكسجين = 2 × 16
= 32 وحدة كتل ذرية.
ولحساب الكتلة الجزيئية التقريبية للجزيئات التي تحتوي على ذرات عناصر مختلفة نجمع حاصل ضرب كلّ ذرة بكتلتها الذرية التقريبية.
مثال:
حساب الكتلة الجزيئية التقريبية للماء H2O .
الكتلة الذرية التقريبية للهيدروجين = 1
الكتلة الذرية التقريبية للأكسجين = 16
الحل:
لاحظ أن جزيء الماء يحتوي على ذرتي هيدروجين، وذرة أكسجين واحدة، وعليه فإن الكتلة الجزيئية التقريبية للماء تحسب كالتالي:
الكتلة الجزيئية للماء = (1 × 16 ) + (2 × 1)
= 18 وحدة كتل ذرية.
سؤال: ••••••••
بالرجوع إلى الجدول الدوري احسب الكتلة الجزيئية لكلٍّ من المواد الآتية:
H2SO4 , MgF2 , NaCl , Cl2
الإجابة:
الكتلة الجزيئية لـ Cl2 = (2 × 35,5)
= 71 وحدة كتل ذرية.
الكتلة الجزيئية لـ NaCl = (1 × 23 ) + (1 × 35,5)
= 58,5 وحدة كتل ذرية.
الكتلة الجزيئية لـ MgF2 = (1 × 24 ) + (2 × 19)
= 62 وحدة كتل ذرية.
الكتلة الجزيئية لـ H2SO4 = (2 × 1 ) + (1 × 32) + (4 × 16)
= 98 وحدة كتل ذرية.
أسئلة المحتوى وإجاباتها
أتحقق صفحة (23):
1- أحسب الكتلة الجزيئية لجزيء الجلوكوز C6H12O6
الكتل الذرية (O = 16 , C = 12 , H = 1).
= (Am H x N) Mm = (Am C x N) + (Am O x N)
Mm = (12 x 1) + (12 x 6) + (16 x 6) = 180 amu
2- أحسب كتلة الصيغة للمركب NaCl
الكتل الذرية (Cl = 35.5 , Na = 23).
Fm = (Am Na x N) + (Am Cl x N)
Fm = (23 x 1) + (35.5 x 1) = 58.5 amu
أفكر صفحة (25):
ما نوع الجسيمات في كل مما يأتي:
Na , N2 , K+ , NaCl ؟
Na : ذرات.
N2 : جزيئات.
K+ : أيونات.
NaCl : وحدات صيغة.
أتحقق صفحة (26):
1- أحسب عدد ذرات عنصر البوتاسيوم K الموجودة في 1 x 103 منه؟
N = NA x n
N = 6.022 x 1026
2- عينة من مركب ما كتلتها 4 g ، والكتلة المولية Mr للمركب؛ فما عدد المولات n ؟
n = 0.1 mol
إجابات أسئلة مراجعة الدرس
السؤال الأول:
الفكرة الرئيسة: أوضح المقصود بكلّ من:
الكتلة الذرية النسبية: متوسط الكتل الذرية لنظائر ذرة عنصر ما.
الكتلة الجزيئية النسبية: مجموع الكتل الذرية النسبية للذرات الموجودة في الجزيء الذي ترتبط ذراته بروابط تساهمية مقيسة بوحدة amu .
الكتلة المولية: كتلة المول الواحد من دقائق المادة.
كتلة الصيغة النسبية: مجموع الكتل الذرية للعناصر في وحدة الصيغة للمركب الأيوني.
المول: الوحدة الدولية التي تُستخدم في قياس كميات المواد في التفاعلات الكيميائية.
السؤال الثاني:
أجد الكتلة المولية (Mr) لكلّ من C2H5OH , CH4 .
C2H5OH = (12 x 2) + (16 x 1) + (1 x 6) = 46 g/mol
CH4 = (12 x 1) + (1 x 4) = 16 g/mol
السؤال الثالث:
أجد كتلة الصيغة (Fm) للمركبين Ca(OH)2 , Mg(NO3)2 .
Mg(NO3)2 = 128 g/mol
Ca(OH)2 = 128 g/mol
السؤال الرابع:
أحسب عدد المولات (n) الموجودة في 72g من عنصر المغنيسيوم.
n = 3 mol
السؤال الخامس:
أحسب كتلة 0.1 mol من ذرات الألمنيوم.
0.1 مول كتلته 2.7 g
السؤال السادس:
أحسب عدد جزيئات NH3 الموجودة في 2 مول منها.
N = 6.022 x 1023 x 2 = 1.2 x 1024
السؤال السابع:
أوضح المقصود بعدد أفوجادرو.
عدد أفوجادرو هو 6.022 x 1023 من الذرات أو الأيونات أو الجزيئات أو وحدات الصيغة.
السؤال الثامن:
أكمل الجدول الآتي:

الدرس الثالث: الحسابات الكيميائية
مصطلحات ومفاهيم علمية
ستتعرف في هذا الدرس على المصطلحات والمفاهيم العلمية التالية:
| النسبة المئوية بالكتلة | Percentage Composition |
| الصيغة الأولية | Empirical Formula |
| الصيغة الجزيئية | Molecular Formula |
| المردود المئوي | Percentage Yield |
| النسبة المولية | Mole Percentage |
المردود المئوي
Percentage Yield
يحرص الكيميائيون في المصانع على حساب المردود المئوي للتفاعل، والذي يُمثل بالعلاقة:

الناتج النظري: أكبر كتلة يمكن الحصول عليها من استهلاك كتلة معلومة من إحدى المواد المتفاعلة.
الناتج الفعلي: الكتلة التي نحصل عليها عمليًا في المختبر أو الصناعة.
وفي الغالب يكون الناتج الفعلي أقل من الناتج النظري؛ أي أن المردود المئوي أقل من 100% ، ويعود ذلك لعدّة عوامل، منها:
- عدم اكتمال التفاعل.
- استعمال مواد متفاعلة غير نقية.
- فقدان جزء من الناتج عن طريق الترشيح أو نقله إلى وعاء آخر.
- الخطأ في القياس.
لذا يحرص الكيميائيون على حساب المردود المئوي وذلك لتحسين ظروف التفاعل، للوصول إلى ناتج فعلي قريب من الناتج النظري، أي أن يكون المردود المئوي قريب من 100%.
مثال:
سخن 120 غ من ثاني أكسيد السليكون SiO2 مع كمية كافية من الكربون C حسب المعادلة:
SiO2 + 3C → SiC+ 2CO
فإذا نتج عملياً في المختبر 50 غ من كربيد السليكون SiC ، فاحسب المردود المئوي للتفاعل. (الكتلة المولية لـ SiO2 = 60 غ/مول، ولـ SiC = 40 غ/مول).
الحل:
كتلة الناتج الفعلي = 50 غ.
نحسب الناتج النظري كالتالي:
المادة المعطاة هي أكسيد السليكون SiO2 ، والمادة المطلوبة SiC .
نحسب عدد مولات أكسيد السليكون:

ومن المعادلة الكيميائية الموزونة نربط علاقة بين عدد مولات أكسيد السليكون وكربيد الكالسيوم:
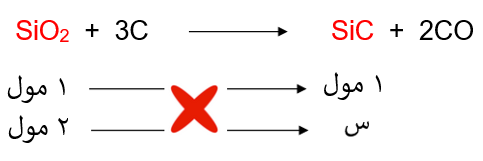
إذاً: عدد مولات كربيد الكالسيوم = 2 مول.
نحسب كتلة كربيد الكالسيوم من عدد مولاته، وهي تمثل كتلة الناتج النظري:
كتلة كربيد الكالسيوم = عدد مولاته × الكتلة المولية
= 2 × 40 = 80 غ
والآن نحسب المردود المئوي للتفاعل:

سؤال:
يُحضر الميثانول CH3OH في الصناعة حسب المعادلة الآتية:
CO + 2H2 → CH3OH
فإذا تفاعل 100 غ من H2 مع كمية كافية من CO ، ونتج 700 غ من الميثانول CH3OH في المصنع، فاحسب المردود المئوي للتفاعل (الكتلة المولية لـ C = 12 ، H = 1 ، و O = 16 غ/مول).
الحل:
كتلة الناتج الفعلي = 700 غ.
نحسب الناتج النظري كالتالي:
المادة المعطاة هي الهيدروجين H2 ، والمادة المطلوبة CH3OH .
نحسب عدد مولات الهيدروجين:

ومن المعادلة الكيميائية الموزونة نربط علاقة بين عدد مولات الهيدروجين والميثانول:
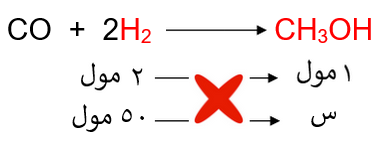
إذاً: عدد مولات الميثانول = 25 مول.
نحسب كتلة الميثانول من عدد مولاته، وهي تمثل كتلة الناتج النظري:
كتلة الميثانول = عدد مولاته × الكتلة المولية
= 25 × 32 = 800 غ
والآن نحسب المردود المئوي للتفاعل:

النسبة المئوية لكتلة العنصر
يستفيد الكيميائيون من حساب النسب المئوية للعناصر في مركبٍ ما في تحديد صيغته الجزيئية.
مثال (1):
احسب النسب المئوية الكتلية للكربون والهيدروجين في الميثان CH4 .
الكتلة الذرية للهيدروجين = 1
الكتلة الذرية للكربون = 12
الحل:
أولاً: نحسب الكتلة المولية للميثان.
الكتلة المولية للميثان CH4 = 1 (C) + 4 (H)
الكتلة المولية للميثان CH4 = 1 (12) + 4 (1)
الكتلة المولية للميثان CH4 = (12) + (4) = 16 غ/مول
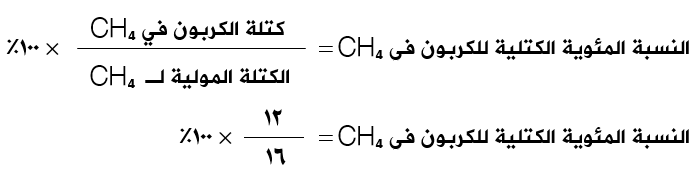
النسبة المئوية الكتلية للكربون = 75%

النسبة المئوية الكتلية للهيدروجين = 25%
أو:
النسبة المئوية الكتلية للهيدروجين = 100% - 75% = 25%
مثال (2):
احسب النسب المئوية الكتلية للكربون والأكسجين في ثاني أكسيد الكربون CO2 .
الكتلة الذرية للأكسجين = 16
الكتلة الذرية للكربون = 12
الحل:
أولاً: نحسب الكتلة المولية لثاني أكسيد الكربون.
الكتلة المولية لثاني أكسيد الكربون CO2 = 1 (C) + 2 (O)
الكتلة المولية لثاني أكسيد الكربون CO2 = 1 (12) + 2 (16)
الكتلة المولية لثاني أكسيد الكربون CO2 = (12) + (32)
الكتلة المولية لثاني أكسيد الكربون CO2 = 44 غ/مول

النسبة المئوية الكتلية للكربون = 27% تقريباً.
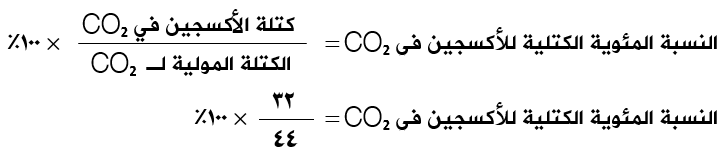
النسبة المئوية الكتلية للأكسجين = 73% تقريباً.
أو:
النسبة المئوية الكتلية للأكسجين = 100% - 27% = 73%
مثال (3):
عند تحليل عينة من مركبٍ مجهول يتكون من الكبريت والأكسجين فقط، فإذا علمت أن كتلة الكبريت في العينة = 1,6 غرام وكتلة الأكسجين في العينة = 2,4 غرام، احسب النسب المئوية الكتلية للكبريت والأكسجين في المركب.
الحل:
كتلة الكبريت في العينة = 1,6 غ.
كتلة الأكسجين في العينة = 2,4 غ
كتلة العينة = 1,6 + 2,4 = 4 غ
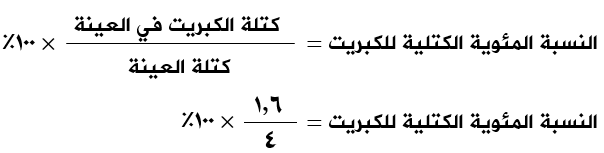
النسبة المئوية الكتلية للكبريت = 40%

النسبة المئوية الكتلية للأكسجين = 60%
أو:
النسبة المئوية الكتلية للأكسجين = 100% - 40% = 60%
أسئلة المحتوى وإجابتها
أتحقق: صفحة (29):
مثال:
سخن 120 غ من ثاني أكسيد السليكون SiO2 مع كمية كافية من الكربون C حسب المعادلة:
SiO2 + 3C → SiC+ 2CO
فإذا نتج عملياً في المختبر 50 غ من كربيد السليكون SiC ، فاحسب المردود المئوي للتفاعل. (الكتلة المولية لـ SiO2 = 60 غ/مول، ولـ SiC = 40 غ/مول).
الحل:
كتلة الناتج الفعلي = 50 غ.
نحسب الناتج النظري كالتالي:
المادة المعطاة هي أكسيد السليكون SiO2 ، والمادة المطلوبة SiC .
نحسب عدد مولات أكسيد السليكون:

ومن المعادلة الكيميائية الموزونة نربط علاقة بين عدد مولات أكسيد السليكون وكربيد الكالسيوم:

إذاً: عدد مولات كربيد الكالسيوم = 2 مول.
نحسب كتلة كربيد الكالسيوم من عدد مولاته، وهي تمثل كتلة الناتج النظري:
كتلة كربيد الكالسيوم = عدد مولاته × الكتلة المولية
= 2 × 40 = 80 غ
والآن نحسب المردود المئوي للتفاعل:

سؤال:
يُحضر الميثانول CH3OH في الصناعة حسب المعادلة الآتية:
CO + 2H2 → CH3OH
فإذا تفاعل 100 غ من H2 مع كمية كافية من CO ، ونتج 700 غ من الميثانول CH3OH في المصنع، فاحسب المردود المئوي للتفاعل (الكتلة المولية لـ C = 12 ، H = 1 ، و O = 16 غ/مول).
الحل:
كتلة الناتج الفعلي = 700 غ.
نحسب الناتج النظري كالتالي:
المادة المعطاة هي الهيدروجين H2 ، والمادة المطلوبة CH3OH .
نحسب عدد مولات الهيدروجين:

ومن المعادلة الكيميائية الموزونة نربط علاقة بين عدد مولات الهيدروجين والميثانول:

إذاً: عدد مولات الميثانول = 25 مول.
نحسب كتلة الميثانول من عدد مولاته، وهي تمثل كتلة الناتج النظري:
كتلة الميثانول = عدد مولاته × الكتلة المولية
= 25 × 32 = 800 غ
والآن نحسب المردود المئوي للتفاعل:

النسبة المئوية لكتلة العنصر
يستفيد الكيميائيون من حساب النسب المئوية للعناصر في مركبٍ ما في تحديد صيغته الجزيئية.
مثال (1):
احسب النسب المئوية الكتلية للكربون والهيدروجين في الميثان CH4 .
الكتلة الذرية للهيدروجين = 1
الكتلة الذرية للكربون = 12
الحل:
أولاً: نحسب الكتلة المولية للميثان.
الكتلة المولية للميثان CH4 = 1 (C) + 4 (H)
الكتلة المولية للميثان CH4 = 1 (12) + 4 (1)
الكتلة المولية للميثان CH4 = (12) + (4) = 16 غ/مول

النسبة المئوية الكتلية للكربون = 75%

النسبة المئوية الكتلية للهيدروجين = 25%
أو:
النسبة المئوية الكتلية للهيدروجين = 100% - 75% = 25%
مثال (2):
احسب النسب المئوية الكتلية للكربون والأكسجين في ثاني أكسيد الكربون CO2 .
الكتلة الذرية للأكسجين = 16
الكتلة الذرية للكربون = 12
الحل:
أولاً: نحسب الكتلة المولية لثاني أكسيد الكربون.
الكتلة المولية لثاني أكسيد الكربون CO2 = 1 (C) + 2 (O)
الكتلة المولية لثاني أكسيد الكربون CO2 = 1 (12) + 2 (16)
الكتلة المولية لثاني أكسيد الكربون CO2 = (12) + (32)
الكتلة المولية لثاني أكسيد الكربون CO2 = 44 غ/مول

النسبة المئوية الكتلية للكربون = 27% تقريباً.
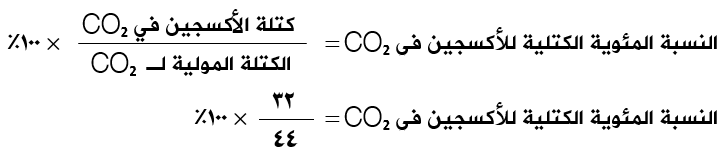
النسبة المئوية الكتلية للأكسجين = 73% تقريباً.
أو:
النسبة المئوية الكتلية للأكسجين = 100% - 27% = 73%
مثال (3):
عند تحليل عينة من مركبٍ مجهول يتكون من الكبريت والأكسجين فقط، فإذا علمت أن كتلة الكبريت في العينة = 1,6 غرام وكتلة الأكسجين في العينة = 2,4 غرام، احسب النسب المئوية الكتلية للكبريت والأكسجين في المركب.
الحل:
كتلة الكبريت في العينة = 1,6 غ.
كتلة الأكسجين في العينة = 2,4 غ
كتلة العينة = 1,6 + 2,4 = 4 غ
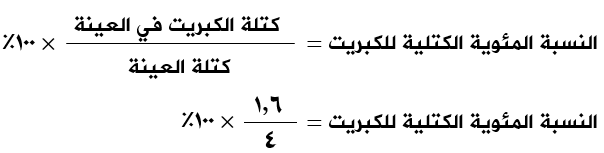
النسبة المئوية الكتلية للكبريت = 40%

النسبة المئوية الكتلية للأكسجين = 60%
أو:
النسبة المئوية الكتلية للأكسجين = 100% - 40% = 60%
أسئلة المحتوى وإجابتها
أتحقق: صفحة (29):
- أحسب النسبة المئوية بالكتلة لعنصر H في مركب كتلته 4.4g ويحتوي 0.8g منه.
- أحسب النسبة المئوية لعنصر الأكسجين في جزيء الجلوكوز الذي صيغته C6H12O6.

أتحقق: صفحة (31):
ما الصيغة الجزيئية لمركب كتلته المولية 58 g/mol ، وصيغته الأولية C2H5 علماً بأن الكتل الذرية (H = 1 , C = 12)؟
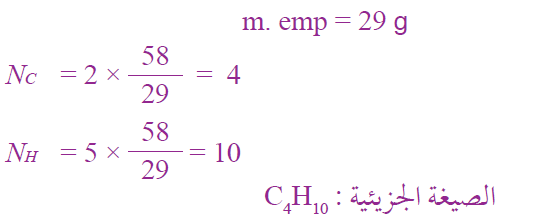
أتحقق: صفحة (35):
اعتماداً على المعادلة الموزونة الآتية:
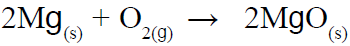
- أحسب عدد مولات O2 اللازمة للتفاعل مع 5 mol من عنصر Mg
- أحسب كتلة MgO الناتجة عن احتراق 6g من عنصر Mg احتراقاً تاماً، بوجود كمية كافية من الأكسجين.
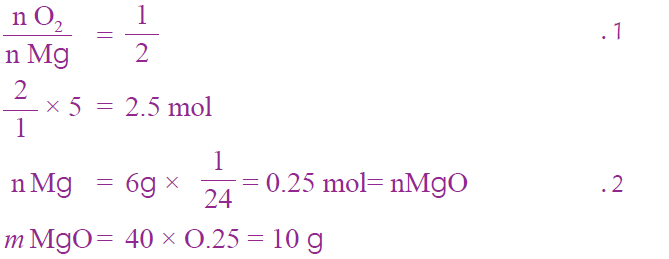
أفكر: صفحة (36):
لماذا تكون نسبة المردود الفعلي أقل بشكل عام من نسبة المردود المتوقع؟
- استخدام مواد متفاعلة غير نقية.
- أو يكون التفاعل غير تام.
- أو يحدث فقدان لجزء من كمية الناتج؛ بسبب نقله من وعاء إلى آخر، أو عمليات الترشيح، أو أية عمليات كيميائية أخرى.
أتحقق: صفحة (36):
ما الفرق بين المردود الفعلي، والمردود المتوقع للتفاعل؟
المردود الفعلي هو كمية المادة الفعلية الناتجة من التفاعل، والتي يحددها الكيميائي من التجارب الدقيقة. أما المردود المتوقع فهو كمية المادة الناتجة المسحوبة نظرياً.
إجابات أسئلة مراجعة الدرس
السؤال الأول:
الفكرة الرئيسة: ما أهمية الحسابات الكيميائية؟
للحسابات الكيميائية أهمية كبيرة في الكيمياء، ومنها:
- إن معرفتنا بالنسبة التي يتم التفاعل على أساسها تمكننا من حساب كمية المادة الناتجة، أو مقدار ما يلزم من إحدى المواد المتفاعلة للتفاعل مع المادة الأخرى.
- تحديد كميات المواد المتفاعلة أو الناتجة بشكل دقيق، يساعدنا في الحصول على منتجٍ نقي خال من الشوائب غير المرغوبة.
السؤال الثاني:
أوضح المقصود بكلّ من:
النسبة المئوية بالكتلة: نسبة كتلة العنصر في المركب إلى الكتلة الكلية للمركب.
الصيغة الأولية: أبسط نسبة عددية صحيحة بين ذرات العناصر المكونة للمركب.
الصيغة الجزيئية: صيغة تبين الأعداد الفعلية للذرات وأنواعها في المركب.
المردود المئوي: النسبة المئوية للمردود الفعلي إلى المردود النظري.
السؤال الثالث:
ما الصيغة الأولية لمركبٍ يتكون من تفاعل 2.3g من الصوديوم Na مع 8g من البروم Br ؟

السؤال الرابع:
ما الصيغة الجزيئية لمركبٍ هيدروكربوني يتكون من 92.3% من الكربون، و 7.7% من الهيدروجين؛ علماً بأن الكتلة المولية للمركب 26 g/mol ؟

السؤال الخامس:
أحسب كتلة أكسيد الحديد Fe2O3 (III) الناتجة من تفاعل 9.12G من كبريتات الحديد FeSO4 (II) علماً بأن معادلة التفاعل الموزونة هي:
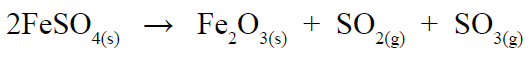
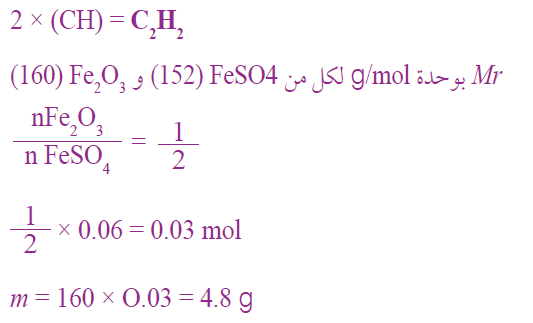
السؤال السادس:
أحسب عدد مولات غاز ثاني أكسيد الكربون CO2 الناتجة من احتراق 6 mol من غاز الإيثان C2H6 احتراقاً تاماً في كمية وافرة من غاز الأكسجين. وذلك المعادلة الموزونة الآتية:
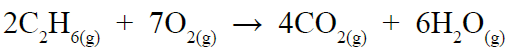
عدد المولات المطلوبة = النسبة المولية x عدد المولات المعطاة
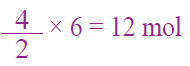
السؤال السابع:
أحسب المردود المئوي لتفاعل ما لإنتاج أكسيد الكالسيوم؛ علماً بأن المردود المتوقع 5.6g والمردود الفعلي 2,8g
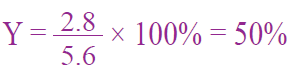
يمكنكم تحميل الشرح PDF هنا