الوحدة الثالثة : نشاط الفلزات
مصطلحات ومفاهيم علمية
تفاعلات الفلزات
ستتعرف في هذا الدرس على المصطلحات والمفاهيم التالية:
تفاعل الفلزات مع الأكسجين
تتفاعل بعض الفلزات مع أكسجين الهواء ويتكون أكسيد الفلز.
وتمثل معادلة التفاعل بالكلمات على النحو التالي:
فلز (صلب)+ أكسجين (غاز) ← أكسيد الفلز (صلب)
ملاحظة:
يجب الانتباه لتكافؤ الفلز عند كتابة معادلة تفاعله مع الأكسجين.
مثال:
يتفاعل فلز الكالسيوم مع أكسجين الهواء وفق المعادلة اللفظية التالية (الكالسيوم ثنائي التكافؤ):
كالسيوم (صلب) + أكسجين (غاز) ← أكسيد الكالسيوم (صلب)
ويمكن تمثيل التفاعل بالمعادلة الرمزية التالية:
2Ca (s) + O2 (g) → 2CaO (s)
سؤال:
إذا علمت أن تكافؤ الألمنيوم = 3، وتكافؤ الأكسجين = 2، فاكتب معادلة كيميائية موزونة تمثل تفاعل الألمنيوم مع الأكسجين.
الحل:
4Al (s)+ 3O2 (g) → 2Al2O3 (s)
وتتفاوت الفلزات في سرعة تفاعلها مع أكسجين الهواء:
تتفاعل بعض الفلزات مع الماء.
يتفاعل الفلز النشط مع الماء، وينتج من تفاعلهما:
وتمثل معادلة التفاعل بالكلمات على النحو التالي:
فلز (صلب)+ ماء (سائل) ← هيدروكسيد الفلز (محلول) + هيدروجين (غاز) + طاقة حرارية
ملاحظة:
يجب الانتباه لتكافؤ الفلز عند كتابة معادلة تفاعله مع الماء.
مثال:
يتفاعل فلز الصوديوم مع الماء وفق المعادلة اللفظية التالية (الصوديوم أحادي التكافؤ):
صوديوم (صلب) + ماء (سائل) ← هيدروكسيد الصوديوم (محلول) + هيدروجين (غاز) + طاقة حرارية
ويمكن تمثيل التفاعل بالمعادلة الرمزية التالية:
2Na (s) + 2H2O (l) → 2NaOH (aq) + H2 (g)
وبما أن هيدروكسيد الصوديوم مركب أيوني، لذا فهو يوجد في المحلول على شكل أيونات، لذا يمكن كتابة المعادلة السابقة على النحو التالي:
2Na (s) + 2H2O (l) → 2Na+ (aq) + 2OH- (aq) + H2 (g)
تعد عناصر المجموعة الأولى من أنشط العناصر، ويجب التعامل معها بحذر شديد.
تتفاعل فلزات المجموعة الأولى كالصوديوم والليثيوم والبوتاسيوم مع الماء البارد، وتعطي النواتج نفسها، إلا أنها تتفاوت في شدة تفاعلها مع الماء.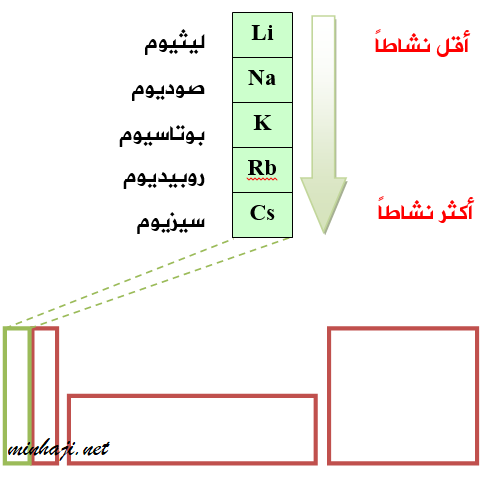
تتفاعل فلزات المجموعة الأولى بقوة مع الماء البارد، وتزداد قوة التفاعل عند استخدام الماء الساخن، ويصبح التفاعل عنيفاً جداً مع البخار.
تفاعل الليثيوم مع الماء
يتفاعل الليثيوم مع الماء البارد، وينتج محلول هيدروكسيد الليثيوم (محلول قاعدي)، ويتصاعد غاز الهيدروجين.
ليثيوم (صلب) + ماء (سائل) ← هيدروكسيد الليثيوم (محلول) + هيدروجين (غاز) + طاقة حرارية
ويمكن تمثيل التفاعل بالمعادلة الرمزية التالية:
2Li (s) + 2H2O (l) → 2LiOH (aq) + H2 (g)
تفاعل البوتاسيوم مع الماء
وبالطريقة نفسها يمكن كتابة تفاعل البوتاسيوم مع الماء.
بوتاسيوم (صلب) + ماء (سائل) ← هيدروكسيد البوتاسيوم (محلول) + هيدروجين (غاز) + طاقة حرارية
ويمكن تمثيل التفاعل بالمعادلة الرمزية التالية:
2K (s) + 2H2O (l) → 2KOH (aq) + H2 (g)
تفاعل فلزات المجموعة الثانية مع الماء
تتفاعل عناصر المجموعة الثانية مع الماء مثل عناصر جارتها المجموعة الأولى، ولكنها أقل نشاطاً منها، وهي تتفاوت في شدة تفاعلها مع الماء.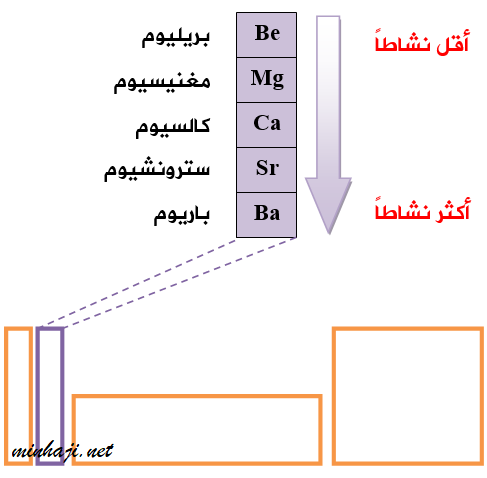
يتفاعل الكالسيوم مع الماء البارد، وينتج محلول هيدروكسيد الكالسيوم (محلول قاعدي)، ويتصاعد غاز الهيدروجين.
كالسيوم (صلب) + ماء (سائل) ← هيدروكسيد الكالسيوم (محلول) + هيدروجين (غاز)
ويمكن تمثيل التفاعل بالمعادلة الرمزية التالية:
Ca (s) + 2H2O (l) → Ca(OH)2 (aq) + H2 (g)
تفاعل المغنيسيوم مع الماء
وبالطريقة نفسها يتفاعل المغنيسيوم مع الماء البارد والساخن، إلا أنه يتفاعل مع الماء أبطأ من تفاعل الكالسيوم مع الماء.
مغنيسيوم (صلب) + ماء (سائل) ← هيدروكسيد المغنيسيوم (محلول) + هيدروجين (غاز)
ويمكن تمثيل التفاعل بالمعادلة الرمزية التالية:
Mg (s) + 2H2O (l) → Mg(OH)2 (aq) + H2 (g)
تتفاعل الفلزات النشطة مع حمض الهيدروكلوريك المخفف، وينتج من تفاعلهما:
وتكتب معادلة التفاعل اللفظية على النحو التالي:
فلز (صلب) + حمض الهيدروكلوريك (محلول) ← كلوريد الفلز (محلول) + هيدروجين (غاز)
وفي هذا التفاعل يحل الفلز النشط محل الهيدروجين الموجود في الحمض.
مثال (1):
يتفاعل فلز الصوديوم مع حمض الهيدروكلوريك وفق المعادلة اللفظية التالية:
صوديوم (صلب) + حمض الهيدروكلوريك (محلول) ← كلوريد الصوديوم (محلول) + هيدروجين (غاز)
وتكتب بالرموز كالتالي:
2Na (s) + 2HCl (aq) → 2NaCl (aq) + H2 (g)
مثال (2):
يتفاعل فلز الخارصين مع حمض الهيدروكلوريك وفق المعادلة اللفظية التالية:
خارصين (صلب) + حمض الهيدروكلوريك (محلول) ← كلوريد الخارصين (محلول) + هيدروجين (غاز)
وتكتب بالرموز كالتالي:
Zn (s) + 2HCl (aq) → ZnCl2 (aq) + H2 (g)
مثال (3):
يتفاعل فلز الألمنيوم مع حمض الهيدروكلوريك وفق المعادلة اللفظية التالية:
ألامنيوم (صلب) + حمض الهيدروكلوريك (محلول) ← كلوريد الألمنيوم (محلول) + هيدروجين (غاز)
وتكتب بالرموز كالتالي:
2Al (s) + 6HCl (aq) → 2AlCl3 (aq) + 3H2 (g)
إلا أن هذا التفاعل يتأخر في البدء، لوجود طبقة من أكسيد الألمنيوم على سطح الفلز تحول دون وصول الحمض إلى سطح الفلز.
وينصح بعدم طهي المواد الغذائية التي تحوي حموضاً في أوعية الألمنيوم؛ لتفاعل الألمنيوم مع الحموض الموجودة في المواد الغذائية.
تفاعلات الفلزات
السؤال الأول:
الفكرة الرئيسة: أعدد مؤشرات حدوث تفاعل الفلزات مع الماء.
السؤال الثاني:
أوضّح المقصود بكل من: نشاط الفلز، السبائك.
السؤال الثالث:
أفسر: يحفظ فلز المغيسيوم Mg في أوعية محكمة الإغلاق.
السؤال الرابع:
أكتب معادلة كيميائية موزونة لكل تفاعل من التفاعلين الآتيين:
أ- الألمنيوم Al مع غاز الأكسجين O2 .
ب- الصوديوم Na مع حمض الهيدروكلوريك HCl المخفف.
السؤال الخامس:
إذا علمت أن الفلزات: (ليثيوم 3Li ، صوديوم 11Na ، بوتاسيوم 19K ، روبيديوم 37Rb ) تقع في المجموعة الأولى من الجدول الدوري.
أتوقع: الفلز الأكثر نشاطاً في تفاعله مع كل من غاز الأكسجين O2 والماء. أبرر إجابتي.
السؤال السادس:
أكمل المعادلات الكيميائية الآتية للتفاعلات التي يمكن حدوثها ثم أزنها:
Al(s) + HCl(aq)
Zn(s) + H2O(l)
Cu(s) + HCl(aq)
Li(s) + O2(g)
السؤال السابع:
أختار الكلمة الماسبة مما يأتي؛ لأكمل بها الفراغات في العبارات أداه:
(الهيدروجين، الأزرق، الأحمر، أكثر نشاطاً، الأكسجين، أقل شاطاً)
أ- فلز الصوديوم Na ........ في تفاعله مع الماء من فلز البوتاسيوم K .
ب- لون ورقة تباع الشمس في أنبوب يحتوي فلز الكالسيوم Ca في الماء هو اللون ........
ج- الغاز الناتج من تفاعل الفلزات مع حمض الهيدروكلوريك HCl هو ........
الدرس الأول: تفاعلات الفلزات
مصطلحات ومفاهيم علمية
تفاعلات الفلزات
ستتعرف في هذا الدرس على المصطلحات والمفاهيم التالية:
| نشاط الفلز | Metal Reactivity |
| أكسيد الفلز | Metal Oxides |
| الملح | Salt |
| السبائك | Alloys |
تتفاعل بعض الفلزات مع أكسجين الهواء ويتكون أكسيد الفلز.
وتمثل معادلة التفاعل بالكلمات على النحو التالي:
فلز (صلب)+ أكسجين (غاز) ← أكسيد الفلز (صلب)
ملاحظة:
يجب الانتباه لتكافؤ الفلز عند كتابة معادلة تفاعله مع الأكسجين.
- الفلزات أحادية التكافؤ كالصوديوم والبوتاسيوم تكون معادلة تفاعلها مع الأكسجين كالتالي:
- الفلزات ثنائية التكافؤ كالكالسيوم والمغنيسيوم تكون معادلة تفاعلها مع الأكسجين كالتالي:
- الفلزات ثلاثية التكافؤ كالألمنيوم تكون معادلة تفاعلها مع الأكسجين كالتالي:
مثال:
يتفاعل فلز الكالسيوم مع أكسجين الهواء وفق المعادلة اللفظية التالية (الكالسيوم ثنائي التكافؤ):
كالسيوم (صلب) + أكسجين (غاز) ← أكسيد الكالسيوم (صلب)
ويمكن تمثيل التفاعل بالمعادلة الرمزية التالية:
2Ca (s) + O2 (g) → 2CaO (s)
سؤال:
إذا علمت أن تكافؤ الألمنيوم = 3، وتكافؤ الأكسجين = 2، فاكتب معادلة كيميائية موزونة تمثل تفاعل الألمنيوم مع الأكسجين.
الحل:
4Al (s)+ 3O2 (g) → 2Al2O3 (s)
وتتفاوت الفلزات في سرعة تفاعلها مع أكسجين الهواء:
- بعض هذه الفلزات يتفاعل بسرعة مثل الصوديوم.
- البعض الآخر يصبح سطحه قاتماً بشكل تدريجي لأنه يتفاعل ببطء، ولكنه يتفاعل بسرعة أكبر عند تسخينه، مثل المغنيسيوم.
- وهنالك فلزات لا تميل للتفاعل مع أكسجين الهواء، مثل الذهب، وهذا ما يفسر احتفاظ قناع المومياء المصرية ببريقه رغم مرور آلاف السنين عليه.
تفاعل الفلزات مع الماء
تتفاعل بعض الفلزات مع الماء.
- يكون الفلز نشطاً جداً إن تفاعل مع الماء البارد، والماء الساخن، وبخار الماء.
- يقل نشاط الفلز إن لم يتفاعل مع الماء البارد، ولكنه يتفاعل مع الماء الساخن، وبخار الماء.
- يعتبر الفلز أقل نشاطاً إن لم يتفاعل مع الماء البارد أو الساخن، وتفاعل فقط مع بخار الماء.
- ويقل نشاط الفلز إن لم يتفاعل مع الماء البارد أو الساخن أو بخار الماء.
يتفاعل الفلز النشط مع الماء، وينتج من تفاعلهما:
- انطلاق غاز الهيدروجين، ويمكن الكشف عنه بعود ثقاب مشتعل.
- تكوّن محلول هيدروكسيد الفلز، وهو محلول يغير لون ورقة تباع الشمس إلى اللون الأزرق، أي أنه محلول قاعدي.
- انطلاق طاقة حرارية، ويستدل على ذلك من سخونة وعاء التفاعل.
وتمثل معادلة التفاعل بالكلمات على النحو التالي:
فلز (صلب)+ ماء (سائل) ← هيدروكسيد الفلز (محلول) + هيدروجين (غاز) + طاقة حرارية
ملاحظة:
يجب الانتباه لتكافؤ الفلز عند كتابة معادلة تفاعله مع الماء.
- الفلزات أحادية التكافؤ كالصوديوم والبوتاسيوم تكون معادلة تفاعلها مع الماء كالتالي:
- الفلزات ثنائية التكافؤ كالكالسيوم والمغنيسيوم والخارصين تكون معادلة تفاعلها مع الماء كالتالي:
- الفلزات ثلاثية التكافؤ كالألمنيوم تكون معادلة تفاعلها مع الماء كالتالي:
مثال:
يتفاعل فلز الصوديوم مع الماء وفق المعادلة اللفظية التالية (الصوديوم أحادي التكافؤ):
صوديوم (صلب) + ماء (سائل) ← هيدروكسيد الصوديوم (محلول) + هيدروجين (غاز) + طاقة حرارية

ويمكن تمثيل التفاعل بالمعادلة الرمزية التالية:
2Na (s) + 2H2O (l) → 2NaOH (aq) + H2 (g)
وبما أن هيدروكسيد الصوديوم مركب أيوني، لذا فهو يوجد في المحلول على شكل أيونات، لذا يمكن كتابة المعادلة السابقة على النحو التالي:
2Na (s) + 2H2O (l) → 2Na+ (aq) + 2OH- (aq) + H2 (g)
تفاعل فلزات المجموعة الأولى مع الماء
تعد عناصر المجموعة الأولى من أنشط العناصر، ويجب التعامل معها بحذر شديد.

تتفاعل فلزات المجموعة الأولى كالصوديوم والليثيوم والبوتاسيوم مع الماء البارد، وتعطي النواتج نفسها، إلا أنها تتفاوت في شدة تفاعلها مع الماء.

تتفاعل فلزات المجموعة الأولى بقوة مع الماء البارد، وتزداد قوة التفاعل عند استخدام الماء الساخن، ويصبح التفاعل عنيفاً جداً مع البخار.
تفاعل الليثيوم مع الماء
يتفاعل الليثيوم مع الماء البارد، وينتج محلول هيدروكسيد الليثيوم (محلول قاعدي)، ويتصاعد غاز الهيدروجين.
ليثيوم (صلب) + ماء (سائل) ← هيدروكسيد الليثيوم (محلول) + هيدروجين (غاز) + طاقة حرارية
ويمكن تمثيل التفاعل بالمعادلة الرمزية التالية:
2Li (s) + 2H2O (l) → 2LiOH (aq) + H2 (g)
تفاعل البوتاسيوم مع الماء
وبالطريقة نفسها يمكن كتابة تفاعل البوتاسيوم مع الماء.
بوتاسيوم (صلب) + ماء (سائل) ← هيدروكسيد البوتاسيوم (محلول) + هيدروجين (غاز) + طاقة حرارية
ويمكن تمثيل التفاعل بالمعادلة الرمزية التالية:
2K (s) + 2H2O (l) → 2KOH (aq) + H2 (g)
تفاعل فلزات المجموعة الثانية مع الماء
تتفاعل عناصر المجموعة الثانية مع الماء مثل عناصر جارتها المجموعة الأولى، ولكنها أقل نشاطاً منها، وهي تتفاوت في شدة تفاعلها مع الماء.

تفاعل الكالسيوم مع الماء
يتفاعل الكالسيوم مع الماء البارد، وينتج محلول هيدروكسيد الكالسيوم (محلول قاعدي)، ويتصاعد غاز الهيدروجين.
كالسيوم (صلب) + ماء (سائل) ← هيدروكسيد الكالسيوم (محلول) + هيدروجين (غاز)
ويمكن تمثيل التفاعل بالمعادلة الرمزية التالية:
Ca (s) + 2H2O (l) → Ca(OH)2 (aq) + H2 (g)
تفاعل المغنيسيوم مع الماء
وبالطريقة نفسها يتفاعل المغنيسيوم مع الماء البارد والساخن، إلا أنه يتفاعل مع الماء أبطأ من تفاعل الكالسيوم مع الماء.
مغنيسيوم (صلب) + ماء (سائل) ← هيدروكسيد المغنيسيوم (محلول) + هيدروجين (غاز)
ويمكن تمثيل التفاعل بالمعادلة الرمزية التالية:
Mg (s) + 2H2O (l) → Mg(OH)2 (aq) + H2 (g)
تفاعل الفلزات مع حمض الهيدروكلوريك المخفف
تتفاعل الفلزات النشطة مع حمض الهيدروكلوريك المخفف، وينتج من تفاعلهما:
- انطلاق غاز الهيدروجين، ويمكن الاستدلال على تكونه بتقريب عود ثقاب مشتعل.
- تكوّن محلول كلوريد الفلز.
- انطلاق طاقة حرارية، ويستدل على ذلك سخونة وعاء التفاعل.
وتكتب معادلة التفاعل اللفظية على النحو التالي:
فلز (صلب) + حمض الهيدروكلوريك (محلول) ← كلوريد الفلز (محلول) + هيدروجين (غاز)
وفي هذا التفاعل يحل الفلز النشط محل الهيدروجين الموجود في الحمض.
مثال (1):
يتفاعل فلز الصوديوم مع حمض الهيدروكلوريك وفق المعادلة اللفظية التالية:
صوديوم (صلب) + حمض الهيدروكلوريك (محلول) ← كلوريد الصوديوم (محلول) + هيدروجين (غاز)
وتكتب بالرموز كالتالي:
2Na (s) + 2HCl (aq) → 2NaCl (aq) + H2 (g)
مثال (2):
يتفاعل فلز الخارصين مع حمض الهيدروكلوريك وفق المعادلة اللفظية التالية:
خارصين (صلب) + حمض الهيدروكلوريك (محلول) ← كلوريد الخارصين (محلول) + هيدروجين (غاز)
وتكتب بالرموز كالتالي:
Zn (s) + 2HCl (aq) → ZnCl2 (aq) + H2 (g)
مثال (3):
يتفاعل فلز الألمنيوم مع حمض الهيدروكلوريك وفق المعادلة اللفظية التالية:
ألامنيوم (صلب) + حمض الهيدروكلوريك (محلول) ← كلوريد الألمنيوم (محلول) + هيدروجين (غاز)
وتكتب بالرموز كالتالي:
2Al (s) + 6HCl (aq) → 2AlCl3 (aq) + 3H2 (g)
إلا أن هذا التفاعل يتأخر في البدء، لوجود طبقة من أكسيد الألمنيوم على سطح الفلز تحول دون وصول الحمض إلى سطح الفلز.
وينصح بعدم طهي المواد الغذائية التي تحوي حموضاً في أوعية الألمنيوم؛ لتفاعل الألمنيوم مع الحموض الموجودة في المواد الغذائية.
أسئلة مراجعة الدرس الأول
تفاعلات الفلزات
السؤال الأول:
الفكرة الرئيسة: أعدد مؤشرات حدوث تفاعل الفلزات مع الماء.
السؤال الثاني:
أوضّح المقصود بكل من: نشاط الفلز، السبائك.
السؤال الثالث:
أفسر: يحفظ فلز المغيسيوم Mg في أوعية محكمة الإغلاق.
السؤال الرابع:
أكتب معادلة كيميائية موزونة لكل تفاعل من التفاعلين الآتيين:
أ- الألمنيوم Al مع غاز الأكسجين O2 .
ب- الصوديوم Na مع حمض الهيدروكلوريك HCl المخفف.
السؤال الخامس:
إذا علمت أن الفلزات: (ليثيوم 3Li ، صوديوم 11Na ، بوتاسيوم 19K ، روبيديوم 37Rb ) تقع في المجموعة الأولى من الجدول الدوري.
أتوقع: الفلز الأكثر نشاطاً في تفاعله مع كل من غاز الأكسجين O2 والماء. أبرر إجابتي.
السؤال السادس:
أكمل المعادلات الكيميائية الآتية للتفاعلات التي يمكن حدوثها ثم أزنها:
Al(s) + HCl(aq)
Zn(s) + H2O(l)
Cu(s) + HCl(aq)
Li(s) + O2(g)
السؤال السابع:
أختار الكلمة الماسبة مما يأتي؛ لأكمل بها الفراغات في العبارات أداه:
(الهيدروجين، الأزرق، الأحمر، أكثر نشاطاً، الأكسجين، أقل شاطاً)
أ- فلز الصوديوم Na ........ في تفاعله مع الماء من فلز البوتاسيوم K .
ب- لون ورقة تباع الشمس في أنبوب يحتوي فلز الكالسيوم Ca في الماء هو اللون ........
ج- الغاز الناتج من تفاعل الفلزات مع حمض الهيدروكلوريك HCl هو ........
الدرس الثاني: سلسلة النشاط الكيميائي وتآكل الفلزات
سيتم اضافة الشرح للدرس الثاني قريبا
لتحميل الشرح ملف PDF هنا
لتحميل الشرح ملف PDF هنا